Atomska i molekularna struktura
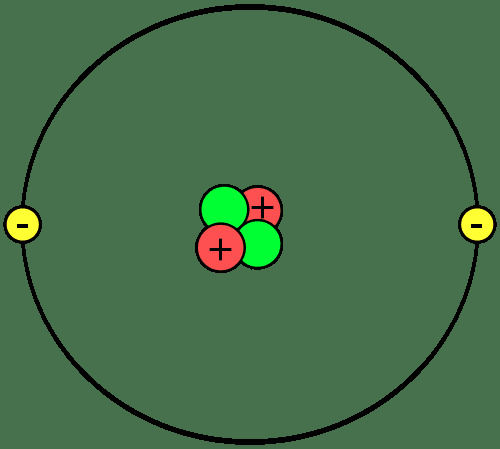
Građa materije su atomi, koji se udružuju u tvorbu molekula ili spojeva. Važno je znati dijelove atoma, što su ioni i izotopi i kako se atomi spajaju.
Dijelovi atoma
Atomi se sastoje od tri komponente:
- protoni - pozitivni električni naboj
- neutroni - bez električnog naboja
- elektroni - negativni električni naboj
Protoni i neutroni tvore jezgro ili središte svakog atoma. Elektroni kruže oko jezgre. Dakle, jezgra svakog atoma ima neto pozitivan naboj, dok vanjski dio atoma ima neto negativan naboj. U kemijskim reakcijama, atomi gube, dobivaju ili dijele elektrone. Jezgro ne sudjeluje u običnim kemijskim reakcijama, iako propadanje i nuklearne reakcije mogu uzrokovati promjene u atomskom jezgru.
Atomi, joni i izotopi
Broj protona u nekom atomu određuje o kojem se elementu radi. Svaki element ima jedno ili dvo slovo simbol koji se koristi da se identificira u kemijskim formulama i reakcijama. Simbol helija je He. Atom s dva protona je atom helija, bez obzira koliko neutrona ili elektrona ima. Atom može imati isti broj protona, neutrona i elektrona ili se broj neutrona i / ili elektrona može razlikovati od broja protona.
Atomi koji nose neto pozitivan ili negativan električni naboj su ioni. Na primjer, ako atom helija izgubi dva elektrona, on bi imao neto naboj +2, što bi bilo napisano He2+.
Varirajući broj neutrona u nekom atomu određuje koji izotop elementa. Atomi se mogu napisati nuklearnim simbolima kako bi se identificirao njihov izotop, gdje je broj nukleona (protoni plus neutroni) je naveden gore i s lijeve strane simbola elementa, s brojem protona dolje navedenim i lijevo od simbol. Na primjer, tri izotopa vodika su:
11H, 21H, 31H
Budući da znate da se broj protona nikada ne mijenja za atom elementa, izotopi se češće pišu korištenjem simbola elementa i broja nukleona. Na primjer, mogli biste napisati H-1, H-2 i H-3 za tri izotopa vodika ili U-236 i U-238 za dva uobičajena izotopa urana.
Atomski broj i atomska masa
atomski broj atoma identificira njegov element i njegov broj protona. atomska težina je broj protona plus broj neutrona u elementu (jer je masa elektrona toliko mala u usporedbi s protonom i neutronima da se u biti ne broji). Atomska masa ponekad se naziva atomskom masom ili brojem atomske mase. Atomski broj helija je 2. Atomska masa helija je 4. Imajte na umu da atomska masa elementa u periodičnoj tablici nije cijeli broj. Na primjer, atomska masa helija dana je kao 4.003, a ne 4. To je zato što periodična tablica odražava prirodno obilje izotopa nekog elementa. U kemijskim proračunima koristite atomsku masu navedenu na periodičnoj tablici, pod pretpostavkom da uzorak nekog elementa odražava prirodni raspon izotopa za taj element.
molekule
Atomi međusobno djeluju, često tvoreći međusobno kemijske veze. Kad se dva ili više atoma vežu jedan s drugim, tvore molekulu. Molekula može biti jednostavna, poput H2ili složenije, poput C6H12O6. Pretplate označavaju broj svake vrste atoma u molekuli. Prvi primjer opisuje molekulu koju tvore dva atoma vodika. Drugi primjer opisuje molekulu koja tvori 6 atoma ugljika, 12 atoma vodika i 6 atoma kisika. Iako biste mogli pisati atome bilo kojim redoslijedom, konvencija je prvo napisati pozitivno nabijenu prošlost molekule, nakon čega slijedi negativno nabijeni dio molekule. Dakle, natrijev klorid je napisan NaCl, a ne ClNa.
Bilješke i pregled periodične tablice
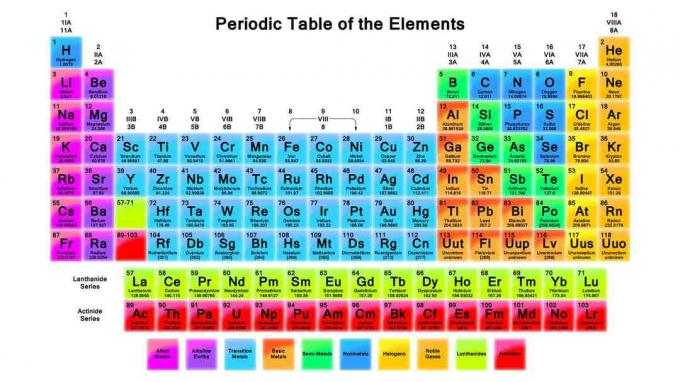
Periodna tablica važan je alat u kemiji. Ove bilješke pregledavaju tablicu perioda, način njezina organiziranja i trendove periodičnih tablica.
Izum i organizacija periodične tablice
1869. god. Dmitri Mendeleev organizirao je kemijske elemente u periodičnu tablicu sličnu onoj koju danas koristimo, osim njegovih elemenata bili su poredani prema povećanju atomske težine, dok je moderni stol organiziran povećanjem atomske mase broj. Način na koji su elementi organizirani omogućava uvid u trendove svojstava elemenata i predviđanje ponašanja elemenata u kemijskim reakcijama.
Pozvani su redovi (pomicanje lijevo udesno) razdoblja. Elementi u nekom razdoblju imaju istu najvišu razinu energije za neiskorišteni elektron. Kako se veličina atoma povećava, postoji i više razine energije po razini energije, pa postoji i više elemenata u razdobljima koji su nadalje navedeni ispod tablice.
Stupci (krećući se od vrha prema dnu) čine osnovu elementa grupe. Elementi u skupinama dijele isti broj valentnih elektrona ili vanjskog rasporeda ljuske elektrona, što elementima u grupi daje nekoliko zajedničkih svojstava. Primjeri skupina elemenata su alkalni metali i plemeniti plinovi.
Trendovi ili periodičnost tablice periodične tablice
Organizacija periodične tablice omogućuje uvid u trendove svojstava elemenata. Važni trendovi odnose se na atomski polumjer, ionizacijsku energiju, elektronegativnost i afinitet elektrona.
-
Atomski polumjer
Atomski polumjer odražava veličinu atoma. Atomski polumjer smanjuje pomicanje s lijeva na desno kroz razdoblje i povećava pomicanje od vrha do dna niz grupe elemenata. Iako biste mogli pomisliti da bi atomi jednostavno postali veći kako dobivaju više elektrona, elektroni ostaju u ljusci, dok sve veći broj protona vuče ljuske bliže jezgri. Pomičući se niz skupinu, elektroni se nalaze dalje od jezgre u novim energetskim školjkama, tako da se ukupna veličina atoma povećava. -
Ionizirajuća energija
Ionizirajuća energija je količina energije koja je potrebna za uklanjanje elektrona iz iona ili atoma u plinskom stanju. Energija ionizacije povećava pomicanje s lijeva na desno kroz razdoblje i smanjuje pomicanje od vrha prema dnu niz grupu. -
Elektronegativnost
Elektronegativnost je mjera koliko lako atom formira kemijsku vezu. Što je veća elektronegativnost, to je veća privlačnost za vezanje elektrona. Elektronegativnost smanjuje pomicanje niz grupe elemenata. Elementi s lijeve strane periodičke tablice imaju tendenciju da budu elektropozitivni ili vjerojatnije da će donirati elektron nego prihvatiti jedan. -
Afinitet elektrona
Afinitet elektrona odražava koliko će atom prihvatiti elektron. Afinitet elektrona varira ovisno o grupi elemenata. Plemeniti plinovi imaju afinitet elektrona blizu nule jer su napunili ljuske elektrona. Halogeni imaju visoke afinitete elektrona jer dodavanje elektrona daje atomu potpuno ispunjenu elektronsku ljusku.
Kemijske veze i lijepljenje

Kemijske veze lako je razumjeti ako imate na umu sljedeća svojstva atoma i elektrona:
- Atomi traže najstabilniju konfiguraciju.
- Pravilo okteta kaže da će atomi sa 8 elektrona u svojoj vanjskoj orbitali biti najstabilniji.
- Atomi mogu dijeliti, davati ili uzimati elektrone drugih atoma. To su oblici kemijskih veza.
- Veze nastaju između valentnih elektrona atoma, a ne unutarnjih elektrona.
Vrste kemijskih veza
Dvije glavne vrste kemijskih veza su ionske i kovalentne veze, ali trebate biti svjesni nekoliko oblika vezivanja:
-
Jonske veze
Jonske veze obliku kada jedan atom uzme elektron iz drugog atoma. Primjer: NaCl nastaje ionskom vezom gdje natrij daje svoj valentni elektron kloru. Klor je halogen. Svi halogeni imaju 7 valentnih elektrona i treba im još jedan da dobiju stabilan oktet. Natrij je alkalni metal. Svi alkalijski metali imaju 1 valentni elektron koji oni lako doniraju u obliku veze. -
Kovalentne veze
Kovalentne veze formiraju kada atomi dijele elektrone. Zapravo, glavna razlika je što su elektroni u ionskim vezama bliže povezani s jednim atomskim jezgra ili drugo, koji elektroni u kovalentnoj vezi mogu približno orbitirati oko jednog jezgra kao i druge. Ako je elektron usko povezan s jednim atomom nego drugim, a polarna kovalentna veza mogu tvoriti. Primjer: Kovalentne veze nastaju između vodika i kisika u vodi, H2O. -
Metalna veza
Kad su oba atoma metali, nastaje metalna veza. Razlika u metalu je u tome što bi elektroni mogli biti bilo koji metalni atom, a ne samo dva atoma u spoju. Primjer: Metalne veze vide se u uzorcima čistih elementarnih metala, poput zlata ili aluminija, ili legura, poput mjedi ili bronce.
Možda se pitate kako možete znati je li veza ionska ili kovalentna. Možete pogledati položaj elemenata na periodičnoj tablici ili tablici elemenata electronegativities predvidjeti vrstu obveznice koja će se formirati. Ako su vrijednosti elektronegativnosti vrlo različite jedna od druge, formirat će se ionska veza. Obično je kation metal, a anion nemetal. Ako su oba elementa metali, očekujte da će nastati metalna veza. Ako su vrijednosti elektronegativnosti slične, očekujte da će se formirati kovalentna veza. Veze između dva nemetala su kovalentne veze. Polarne kovalentne veze formiraju se između elemenata koji imaju međusobne razlike između vrijednosti elektronegativnosti.
Kako imenovati spojeve - Nomenklatura kemije
Kako bi kemičari i drugi znanstvenici mogli međusobno komunicirati, Međunarodna unija čiste i primijenjene kemije ili IUPAC dogovorio je sustav nomenklature ili naziva. Čut ćete kemikalije koje se nazivaju njihovim uobičajenim imenima (npr. Sol, šećer i soda bikarbona), ali u laboratoriju biste koristili sustavna imena (npr. Natrijev klorid, saharoza i hidrogenkarbonat). Evo pregleda nekih ključnih točaka o nomenklaturi.
Imenovanje binarnih spojeva
Spojevi mogu biti sastavljeni od samo dva elementa (binarni spojevi) ili više od dva elementa. Za imenovanje binarnih spojeva vrijede određena pravila:
- Ako je jedan od elemenata metal, prvo se imenuje.
- Neki metali mogu tvoriti više pozitivnih iona. Uobičajeno je navesti naboj na ionu pomoću rimskih brojeva. Na primjer, FeCl2 je željezni (II) klorid.
- Ako je drugi element nemetal, ime spoja je metalno ime, a slijedi ga skraćenica (kratica) imena nemetala, a slijedi "ide". Na primjer, NaCl je nazvan natrijev klorid.
- Za spojeve koji se sastoje od dva nemetala, elektropozitivniji element prvo je nazvan. Stabljika drugog elementa je imenovana, a slijedi „ide“. Primjer je HCl, a to je klorovodik.
Imenovanje jonskih spojeva
Uz pravila za imenovanje binarnih spojeva, postoje i dodatne oznake imenovanja za ionske spojeve:
- Neki poliatomski anioni sadrže kisik. Ako element tvori dva oksianiona, onaj s manje kisika završava na -ite, dok onaj s više oksigena završava na -ate. Na primjer:
NE2- je nitrit
NE3- je nitrat